近日,南华大学附属第一医院谭钢教授团队与中南大学湘雅医院、北京大学团队合作在国际知名期刊Advanced Science(IF:15.1,中科院一区)上发表了题为“Near-Infrared-II Nanoparticles for Vascular Normalization Combined with Immune Checkpoint Blockade via Photodynamic Immunotherapy Inhibit Uveal Melanoma Growth and Metastasis”的研究论文。该论文介绍了一种创新的纳米药物策略,旨在引发治疗眼源葡萄膜黑色素瘤的全身抗肿瘤免疫反应。谭钢教授为论文通讯作者,博士研究生郑晓勤为第一作者,南华大学附属第一医院为论文署名第一单位。
葡萄膜黑色素瘤(UM)是一种侵袭性恶性肿瘤,起源于眼睛的黑色素细胞。尽管通过放射治疗或手术能够有效控制原发肿瘤,但50%的UM患者会发展为转移性疾病。UM的总生存率很低,迄今为止没有标准的方法来同时靶向治疗原发性UM和防止进一步转移。
光动力疗法(PDT)因其有效、无创、安全等优点成为治疗眼内肿瘤的有效方法。但由于血管异常导致肿瘤尤其是实体瘤乏氧是该疗法的主要限制。实体瘤通常具有异质性的细胞生长超过其血供,从而导致肿瘤部位的氧浓度非常低(乏氧),并增加了乏氧诱导因子和血管内皮生长因子(VEGF)的表达,导致促血管生成因子和抗血管生成因子的失衡,最终使功能和结构异常的血管表达增加。肿瘤血管异常导致缺氧,进而减少ROS的生成。同时,血管异常还会导致肿瘤特异性细胞毒性T淋巴细胞在肿瘤部位的浸润和活性有限,还会通过招募免疫抑制性免疫细胞进入肿瘤微环境(TME)促进免疫逃逸。
研究人员通过动物实验评估了Combo-NP的生物安全性、生物分布和抗肿瘤活性。结果显示,经Combo-NP+L处理的小鼠肿瘤组织中出现较大的核碎裂、核溶解。同时,TUNEL检测提示,Combo-NP+L组小鼠肿瘤组织中绿色荧光强度明显高于其他组小鼠肿瘤组织。通过实验发现Combo-NP+L对肿瘤生长的抑制作用最强。
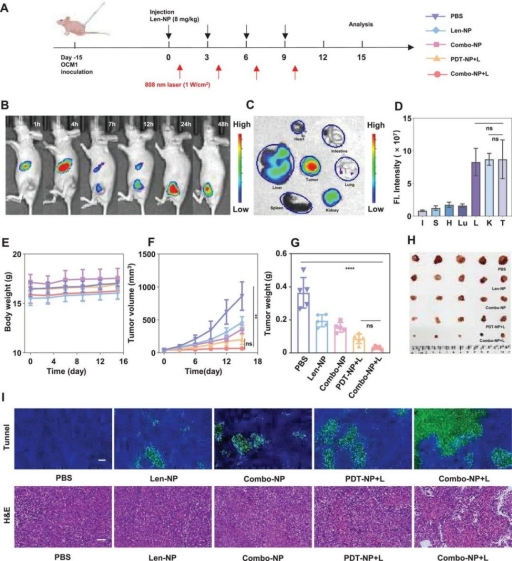
Combo-NP在OCM1荷瘤裸鼠模型中的生物分布和抗肿瘤作用
研究人员进一步研究了Combo-NP联合α-PD-L1 mAb是否能诱导全身抗肿瘤介导的远隔效应并抑制肿瘤转移。为验证该假设,建立了一个双侧B16F10同基因模型来研究远端肿瘤的肿瘤生长和免疫特征。实验结果显示,与PBS相比,Combo-NP+L+α-PD-L1处理的小鼠的MDSCs从13.2%下降到6.6%、和Tregs从15.6%下降到7.6%。其他治疗组小鼠肺内可见转移结节,但Combo-NP+L+α-PD-L1治疗组小鼠肺内未见转移结节。研究证明Combo-NP+L可充分激活抗肿瘤免疫反应用于光动力-免疫治疗,并通过血管正常化和免疫调节改善免疫抑制的肿瘤微环境。进一步联合抗pd - l1单抗可激活更强的全身免疫活性,表现出更强的远隔效应,抑制肿瘤转移。
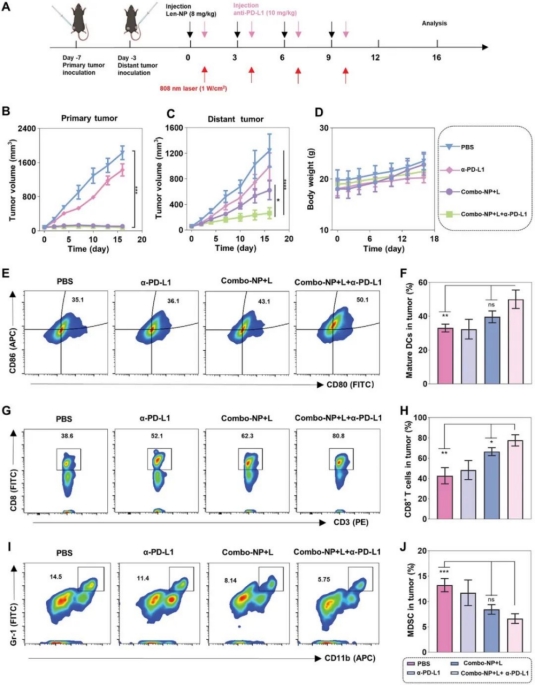
联合应用Combo-NP和α-PD-L1 mAb可诱导B16F10皮下肿瘤模型的全身抗肿瘤效应
本研究表明Combo-NP+L为UM的治疗提供了一种新的、有前景的策略。它还可以作为一种潜在的免疫佐剂来提高抗PD - L1治疗的效率,从而为对抗UM和其他相关癌症提供一种新的治疗模式。
原文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202206932